
Guillaume Paris, Université de Lorraine
Atmosphère, atmosphère… On se focalise souvent sur l’atmosphère lorsque l’on aborde le sujet des émissions de CO2, au risque d’oublier deux autres acteurs clés de la machine climatique : la biomasse et l’océan. Ils captent à eux deux plus de 50 % des quelque 40 milliards de tonnes (Gt) de CO2 émises par les activités humaines.
L’océan nous aide, car en absorbant du CO2, il limite l’augmentation de l’effet de serre. Mais au rythme auquel vont les émissions humaines, c’est à ses risques et périls : le CO2 absorbé entraîne une acidification de ses eaux, un danger majeur pour les écosystèmes.
Pour comprendre les mécanismes complexes qui entrent en jeu, suivons ce que deviennent les molécules de dioxyde de carbone une fois absorbées par les océans.

Des échanges gazeux actifs entre l’air et l’océan
Nous avons tendance à considérer l’océan et l’atmosphère comme deux entités bien distinctes. Cette séparation cache un phénomène important : les échanges gazeux. En effet, les gaz présents dans l’atmosphère, dont le CO2 et l’oxygène, sont solubles dans l’eau.
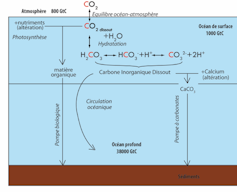
Dans l’eau, le CO2 dissout s’hydrate en acide carbonique (H2CO3). Celui-ci, acide, s’équilibre ensuite avec les ions bicarbonates (HCO3⁻) et carbonates (CO32⁻) déjà présents dans l’eau de mer. C’est là qu’intervient une propriété chimique clé qui contrôle l’acidité de l’océan : l’alcalinité, liée aux éléments apportés notamment par l’altération des continents. Ceux-ci contrebalancent l’acidité provenant de l’acide carbonique (donc du CO2).
Grâce à l’alcalinité, l’océan est légèrement basique : son pH moyen est d’environ 8 (le pH quantifie l’acidité d’un milieu, acide si son pH est inférieur à 7, basique s’il est supérieur). À un pH de 8, la majorité du carbone inorganique (par opposition au carbone organique présent dans la matière vivante) se présente sous forme d’ions bicarbonates. C’est donc sous cette forme que le CO2 se retrouve stocké dans l’eau de mer.
Brassages des eaux sous-marines
Le CO2 est dissout en surface mais n’y reste pas. Il est entraîné par les eaux, soumises aux grands courants océaniques comme la circulation dite thermohaline.
Au niveau des pôles, les eaux froides et denses se chargent en CO2 et plongent dans les profondeurs, entraînant le carbone dissout. Mais les eaux profondes finissent par remonter, entraînant avec elles du CO2. On estime que le CO2 absorbé remonte à la surface des océans en moyenne 1 000 ans plus tard, le temps qu’il faut pour « mélanger » l’océan.
Néanmoins, tout le CO2 ne remonte pas à la surface. Une partie est prélevée par le phytoplancton et les algues pour fabriquer leur matière organique par photosynthèse. Si, à leur mort, ces organismes sédimentent au fond de l’océan, ils transfèrent du carbone organique, donc du CO2, de l’atmosphère vers les sédiments. Il y restera alors stocké sur des échelles de temps supérieures à 100 000 ans. C’est ce qu’on nomme la pompe biologique.
Par ailleurs, de nombreux organismes marins comme les coraux ou les coquillages fabriquent des coquilles ou des squelettes en calcaire. Chimiquement, le calcaire est du carbonate de calcium (CaCO3). Sa synthèse nécessite donc du carbonate (CO3⁻), et prélève ainsi du carbone dissout hors de l’océan. Lorsque ces organismes meurent, le calcaire s’accumule lui aussi dans les sédiments et stocke ainsi du CO3⁻, donc du CO2, sur le long terme : c’est la pompe à carbonate.
Ces deux pompes naturelles libèrent ainsi de la « place » pour que l’océan puisse absorber davantage de carbone. Le CO2 atmosphérique en excès et les perturbations climatiques associées pourraient ainsi se résorber peu à peu au fil des millénaires… mais les sociétés humaines et les écosystèmes ne s’inscrivent pas dans des temps aussi longs.
De plus, les océans ne pourront pas continuer à absorber autant de CO2 qu’aujourd’hui. Tout d’abord, plus la température des eaux va augmenter, à cause du réchauffement climatique, moins elles pourront absorber de CO2. Ensuite, la pompe biologique a besoin de nutriments pour fonctionner, et ceux-ci vont devenir un facteur limitant par rapport aux quantités CO2 disponibles. Enfin, la formation des carbonates est mise en danger par l’acidification des eaux.

Les océans de plus en plus acides
Émettre du CO2 dans l’atmosphère revient en effet à ajouter de l’acide (carbonique) dans l’océan. Or l’acidification océanique a des conséquences dramatiques pour toutes les espèces qui fabriquent des coquilles ou des squelettes en carbonate de calcium, « attaqués » par les acides. Les coraux, les foraminifères, les coccolithophoridés (microalgues qui font partie du plancton) et bien d’autres espèces encore en souffrent. Cette acidification participe au blanchiment des coraux, complique l’ostréiculture ou la mytiliculture et perturbe fortement les écosystèmes marins.
Or le passé nous renseigne sur les dangers encourus lorsque les ajouts de CO2 dans l’atmosphère et donc dans l’océan sont trop rapides pour être contrebalancés par l’altération des continents. Ce fut le cas lors d’un évènement survenu voilà environ 55 millions d’années, le réchauffement du Maximum Thermique du passage Paléocène-Éocène (PETM).
Cet évènement est associé à une émission massive, naturelle, de gaz à effet de serre vers l’atmosphère (méthane et CO2) : 10 000 Gt de carbone (GtC) ont été émises en moins de 50 000 ans, avec des pics estimés à 0,6 GtC/an. Des auteurs ont récemment estimé que le pH a ainsi baissé de 0,3 unités pendant 60 000 ans, que l’accumulation de carbonates a diminué de 50 % alors que la température de surface a augmenté de 5°C !
Il a fallu attendre ensuite plus d’une centaine de milliers d’années pour que l’altération des continents aide l’océan à retrouver son pH initial. Autant dire beaucoup plus long que la durée de vie de nos sociétés.
Trop de CO2 émis, trop rapidement
À l’heure actuelle, le taux d’émission de CO2 par les humains est de l’ordre de 10,9 GtC (ou 40 Gt de CO2) par an, soit 15 fois plus rapide que le pic du PETM. La teneur atmosphérique en CO2 est passée de 280 ppm avant 1850 à 410 ppm en 2018, la température à la surface des continents montre déjà une hausse de 0,9°C entre 1901 et 2012, et le pH de l’océan de surface a baissé de 0,05 unités entre 1980 et 2010.
La hausse des émissions de CO2 a donc de multiples conséquences. Et nous n’avons pas parlé ici de la baisse de la concentration en oxygène dissout dans l’océan due au réchauffement des eaux, générant notamment des zones mortes aux écosystèmes particulièrement perturbés.
L’océan et la vie qu’il abrite, complexe et fragile, figurent parmi les nombreuses victimes des changements induits par les humains. Si nous voulons le préserver – et par là même préserver nos sociétés, compte tenu des services innombrables que l’océan rend à l’humanité – l’urgence est réelle à agir pour limiter nos émissions de C02.
Guillaume Paris, Géochimiste, chargé de recherche CNRS au Centre de recherches pétrographiques et géochimiques de Nancy, Université de Lorraine
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.

